Table of Contents
Farbsehen
Das Farbsehen von Reptilien fasziniert mich besonders, da es unser menschliches Farbsehen so stark übersteigt. Reptilien sehen Farben, die wir uns nicht einmal vorstellen können. Viele Reptilien sind Tetrachromaten, das heißt, sie sehen vier Grundfarben. Der Mensch sieht drei Grundfarben: Rot, Grün und Blau. Viele Reptilien Rot, Grün, Blau und UVA. Das klingt als wäre es “nur eine Farbe mehr”, “4 statt 3”, “33% mehr”, aber tatsächlich ist es eine zusätzliche Farbdimension! Denn wir Menschen sehen ja auch nicht nur Rot, Grün und Blau, sondern noch tausende Mischfarben, wie Orange, Braun, Violett, Gelb, Altrosa, Senfgelb, Flieder, Moosgrün und viele viele mehr. Für Reptilien gibt es noch 10 oder 100 mal mehr Farben, da sie jede Farbe noch mit unterschiedlichen Anteilen an UVA sehen können.
Farbmathematik
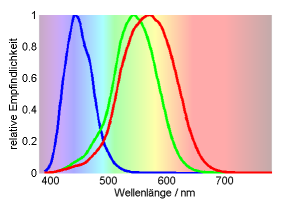 Glücklicherweise hat “Farbe” eine sehr stark mathematische Komponente. Das macht es für uns einfacher, nachzuvollziehen, wie Tiere Farben sehen können. Farbe entsteht, wenn Licht die Photorezeptoren in der Netzhaut trifft. Der Mensch hat drei Photorzeptoren für das Farbsehen am Tag: Zapfen mit maximaler Empfindlichkeit im Blauen, Grünen und Gelben Spektralbereich (den man oft auch Rot-Zapfen nennt, auch wenn er tatsächlich eher im gelben Bereich liegt). Wenn diese drei Zapfen ungefähr gleich viel Licht sehen, nennen wir die Farbe weiß. Wenn der Blau-Zapfen mehr Licht sieht als die anderen zwei, nennen wir die Farbe blau. etc. Mathematisch ist nur das Verhältnis der drei Zapfen wichtig. Man rechnet die Farbe daher als:
Glücklicherweise hat “Farbe” eine sehr stark mathematische Komponente. Das macht es für uns einfacher, nachzuvollziehen, wie Tiere Farben sehen können. Farbe entsteht, wenn Licht die Photorezeptoren in der Netzhaut trifft. Der Mensch hat drei Photorzeptoren für das Farbsehen am Tag: Zapfen mit maximaler Empfindlichkeit im Blauen, Grünen und Gelben Spektralbereich (den man oft auch Rot-Zapfen nennt, auch wenn er tatsächlich eher im gelben Bereich liegt). Wenn diese drei Zapfen ungefähr gleich viel Licht sehen, nennen wir die Farbe weiß. Wenn der Blau-Zapfen mehr Licht sieht als die anderen zwei, nennen wir die Farbe blau. etc. Mathematisch ist nur das Verhältnis der drei Zapfen wichtig. Man rechnet die Farbe daher als:
$$ x = \frac{Gelb}{Gelb + Grün + Blau} \qquad y = \frac{Grün}{Gelb + Grün + Blau}$$
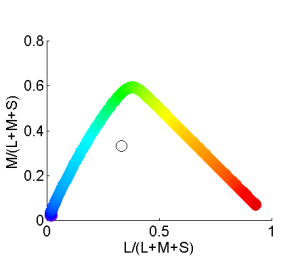 Wenn nur der Gelb-Zapfen Licht sieht, ist $x = \frac{1}{1+0+0} = 1$ und $y = \frac{0}{1+0+0}=0$. Das ist bei sehr langwelligem roten Licht der Fall. Wenn nur der Blau-Zapfen Licht sieht, ist $x = \frac{0}{1+0+0} = 0$ und $y = \frac{0}{1+0+0}=0$. Diese Koordinaten $(x,y)=(1,0)$ für Rot und $(x,y)=(0,0)$ für Blau kann man in ein Diagramm, den sogenannten Farbraum einzeichnen. Er hilft, besser zu verstehen, wie Farben aussehen. Da die Absorptionskurven der drei Zapfen zu stark überlappen, ist es nicht möglich, dass nur der Grün-Zapfen Licht sieht. Ein starkes Signal auf den Grün-Zapfen durch grünes Licht resultiert in der Farbkoordinate $x = \frac{4}{4+6+1} = 0,37$ und $y = \frac{6}{4+6+1}=0,55$
Wenn nur der Gelb-Zapfen Licht sieht, ist $x = \frac{1}{1+0+0} = 1$ und $y = \frac{0}{1+0+0}=0$. Das ist bei sehr langwelligem roten Licht der Fall. Wenn nur der Blau-Zapfen Licht sieht, ist $x = \frac{0}{1+0+0} = 0$ und $y = \frac{0}{1+0+0}=0$. Diese Koordinaten $(x,y)=(1,0)$ für Rot und $(x,y)=(0,0)$ für Blau kann man in ein Diagramm, den sogenannten Farbraum einzeichnen. Er hilft, besser zu verstehen, wie Farben aussehen. Da die Absorptionskurven der drei Zapfen zu stark überlappen, ist es nicht möglich, dass nur der Grün-Zapfen Licht sieht. Ein starkes Signal auf den Grün-Zapfen durch grünes Licht resultiert in der Farbkoordinate $x = \frac{4}{4+6+1} = 0,37$ und $y = \frac{6}{4+6+1}=0,55$
Allgemein zeichnet man im Farbraum eine äußere Begrenzungslinie, den sogenannten Spektralfarbenzug. Er entsteht durch die Farborte der einzelnen Wellenlängen. Da jede Farbe nur durch Mischung von elementaren Spektraltarfarben gebildet werden kann, liegen alle anderen Farben immer im Inneren dieser Begrenzungslinie.. [45Kelber, A., Vorobyev, M., & Osorio, D. (2003). Animal colour vision - behavioural tests and physiological concepts. Biological Reviews, 78, 81–118.]
Dichromaten: Säugetiere
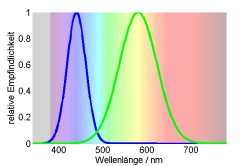 Die meisten Säugetiere sind Dichromaten. Sie besitzen einen Zapfen mit Empfindlichkeit kurzwelligen Bereich “S” (short wavelength) mit maximaler Empfindlichkeit knapp über 400 nm und einem im mittelwelligen Bereich “M” (medium wavelength) und maximaler Empfindlichkeit bei etwa 550 nm. Da wieder nur da Verhältnis zählt, ist der Farbort hier nur eine Zahl: $x = \frac{M}{M+S}$.
Die meisten Säugetiere sind Dichromaten. Sie besitzen einen Zapfen mit Empfindlichkeit kurzwelligen Bereich “S” (short wavelength) mit maximaler Empfindlichkeit knapp über 400 nm und einem im mittelwelligen Bereich “M” (medium wavelength) und maximaler Empfindlichkeit bei etwa 550 nm. Da wieder nur da Verhältnis zählt, ist der Farbort hier nur eine Zahl: $x = \frac{M}{M+S}$.
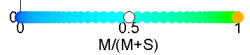 Berechnet man die Farborte für alle Wellenlängen zwischen 400nm und 700nm stellt man fest, dass Licht der Wellenlänge 488nm (für den Menschen blaugrün) in diesem Farbraum weiß erscheint.
Alle Wellenlängen über 540nm (für den Menschen grün-gelb-orange-rot) können nicht unterschieden werden und haben die selbe Farbe. Man sagt auch, Säugetiere sind “Rot-Grün-Blind”
Berechnet man die Farborte für alle Wellenlängen zwischen 400nm und 700nm stellt man fest, dass Licht der Wellenlänge 488nm (für den Menschen blaugrün) in diesem Farbraum weiß erscheint.
Alle Wellenlängen über 540nm (für den Menschen grün-gelb-orange-rot) können nicht unterschieden werden und haben die selbe Farbe. Man sagt auch, Säugetiere sind “Rot-Grün-Blind”
"Echte" Trichromaten: Insekten, Reptilien
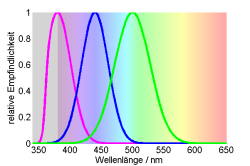 Beim Menschen sind Grün- und Gelbzapfen kaum zu unterscheiden, evolutionär gesehen, sind wir eigentlich Dichromaten, bei denen sich der Langwellige Zapfen verdoppelt hat. Häufiger sind echte Trichromaten, die einen UV, einen kurzwelligen und einen langwelligen Zapfen besitzen. Viele Reptilien aber auch Insekten sind solche Trichromaten.
Beim Menschen sind Grün- und Gelbzapfen kaum zu unterscheiden, evolutionär gesehen, sind wir eigentlich Dichromaten, bei denen sich der Langwellige Zapfen verdoppelt hat. Häufiger sind echte Trichromaten, die einen UV, einen kurzwelligen und einen langwelligen Zapfen besitzen. Viele Reptilien aber auch Insekten sind solche Trichromaten.
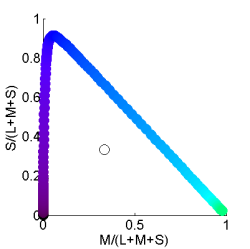 Der Farbraum bei diesen Lebewesen ist deutlich größer als der Farbraum des Menschen. Verschiedene Farben im UVA-Bereich können sehr gut unterschieden werden wogegen Wellenlängen größer als grün nicht unterschieden werden können (grün=gelb=rot).
Der Farbraum bei diesen Lebewesen ist deutlich größer als der Farbraum des Menschen. Verschiedene Farben im UVA-Bereich können sehr gut unterschieden werden wogegen Wellenlängen größer als grün nicht unterschieden werden können (grün=gelb=rot).
Tetrachromaten: Reptilien, Vögel
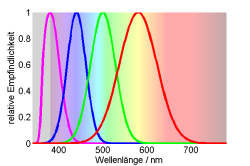 Tetrachromaten besitzen vier Photorezeptoren im UVA-, Blau-, Grün- und Rotbereich. Die Farbkoordinaten sind hier dreidimensional: $ x = \frac{Rot}{Rot+Grün+Blau+UV}$, $y = \frac{Grün}{Rot+Grün+Blau+UV}$, $z = \frac{Blau}{Rot+Grün+Blau+UV}$.
Tetrachromaten besitzen vier Photorezeptoren im UVA-, Blau-, Grün- und Rotbereich. Die Farbkoordinaten sind hier dreidimensional: $ x = \frac{Rot}{Rot+Grün+Blau+UV}$, $y = \frac{Grün}{Rot+Grün+Blau+UV}$, $z = \frac{Blau}{Rot+Grün+Blau+UV}$.
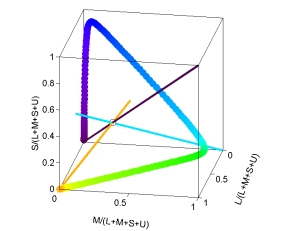 Was bei Dichromaten eine Farbgerade war und bei Trichromaten ein Farbdreieck wird hier zur Farbpyramide. Hier gibt es wieder eine Erweiterung der Mischfarben. So ist es nicht mehr möglich aus zwei Wellenlängen weißes Licht zu mischen, es gibt unter den Wellenlängen keine Komplementärfarben mehr. Die Mischung von Blau und Rot unterscheidet sich von Violett.
Was bei Dichromaten eine Farbgerade war und bei Trichromaten ein Farbdreieck wird hier zur Farbpyramide. Hier gibt es wieder eine Erweiterung der Mischfarben. So ist es nicht mehr möglich aus zwei Wellenlängen weißes Licht zu mischen, es gibt unter den Wellenlängen keine Komplementärfarben mehr. Die Mischung von Blau und Rot unterscheidet sich von Violett.
Untersuchungen zum Farbsehen von Reptilien
Photorezeptoren
Auf der Basis der Netzhaut kann man untersuchen welche Photorezeptoren vorliegen und wie ihre spektrale Reaktion auf einfallendes Licht ist, sowie die anschließende Vernetzung der Photorezeptorsignale zu Gegenfarben.
Die Netzhaut der tagaktiven Echsen und der Schildkröten bildet gewissermaßen den Prototyp des Farbsehens bei Reptilien. Die Netzhaut besteht nur aus Zapfen mit Empfindlichkeit bei den Farben UVA, Blau, Grün und Rot. Durch Öltröpfchen wird die spektrale Empfindlichkeit der Zapfen weiter eingeschränkt, das den Farbraum vergrößert, das Farbsehen also weiter verbessert. Nachtaktive Reptilien haben meist im Lauf der Evolution ihren rot-Zapfen teilweise auch den Grün-Zapfen und die Öltröpfchen verloren und ihr Farbsehen an ihren Lebensraum angepasst.
Der UV-Zapfen kann nur dann seine volle Funktion für das Farbsehen entfalten, wenn Hornhaut und Linse durchlässig für UV-Strahlen sind. Bei Chamäleons begrenzt die Linse die Transmission auf 350nm [12Bowmaker, J. K., & Loew, E. R. (2005). The cone photoreceptors and visual pigments of chameleons. Journal of Comparative Physiology A, 191(10), 925–932.], während beim Taggecko Gonatodes albogularis die Linse die Transmission auf 450nm [443Ellingson, J. M., Fleishman, L. J., & Loew, E. R. (1995). Visual pigments and spectral sensitivity of the diurnal gecko gonatodes albogularis. Journal of Comparative Physiology A, 177(5), 559–567.] und bei Quedenfeldtia trachyblepharus auf 420nm [601Röll, B. (2000). Carotenoid and retinoid -- two pigments in a gecko eye lens. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology, 125(1), 105–112.] beschränkt, so dass der UV-Zapfen nicht mehr angeregt werden kann.
Schildkröten
Die Netzhaut der Schmuckschildkröte ist für Wissenschaftler ein wichtiges Modell um retinale Prozesse zu studieren und dementsprechend sehr gut untersucht [2Ammermüller, J., & Kolb, H. (1996). Functional architecture of the turtle retina. Progress in Retinal and Eye Research, 15(2), 393–433.]. Folgende Photorezeptoren sind im Lichtmikroskop nachgewiesen und ihre Spektrale Absorption gemessen [53Loew, E. R., & Govardovskii, V. I. (2001). Photoreceptors and visual pigments in the red-eared turtle, trachemys scripta elegans. Visual Neuroscience, 18(5), 753–757.]:
- Stäbchen ohne Öltröpfchen mit großen stoppeligen Außensegmenten
Häufigkeit 2-10%
Absorptionsmaximum 519nm - Rot-sensitive Einzelzapfen mit einem großen roten Öltröpfchen
Häufigkeit 26-50%
Absorptionsmaximum 623nm - Grün-sensitive Einzelzapfen mit einem mittleren gelben Öltröpfchen
Häufigkeit 17-27%
Absorptionsmaximum 522nm - Doppelzapfen mit einem rotsensitiven Hauptzapfen mit orangenen Öltröpfchen und einem rotsensitiven Nebenzapfen mit einem gelben Öltröpfen
Häufigkeit 15-20% - Blau-sensitive Einzelzapfen mit blassgrüne Öltröpfchen das unter UV-Strahlung fluoresziert
Häufigkeit 6-18%
Absorptionsmaximum 462nm - UV-sensitive Einzelzapfen mit farblosem kleinen Öltröpfchen
Häufigkeit 1-6%
Absorptionsmaximum 360nm
Chamäleons
Chamäleons besitzen eine reine Zapfenretina ohne Stäbchen bei der Einzelzapfen mit vier unterschiedlichen Farbsensitivitäten nachgewiesen sind [12Bowmaker, J. K., & Loew, E. R. (2005). The cone photoreceptors and visual pigments of chameleons. Journal of Comparative Physiology A, 191(10), 925–932.]. Trotz der unterschiedlichen Lebensweise der vier untersuchten Chamäleonarten unterschieden sich die Zapfen kaum.
- LWL-Zapfen mit maximaler Empfindlichkeit bei ~580nm, die ein gelbes Öltröpfchen mit Filter unterhalb 485nm besitzen
- MWL-Zapfen mit maximaler Empfindlichkeit bei ~480nm, die ein gelbes Öltröpfchen mit Filter unterhalb 495nm besitzen
- SWL-Zapfen mit maximaler Empfindlichkeit bei ~440nm, die in klares Öltröpfchen, das unterhalb von 390nm absorbiert besitzen
- UV-Zapfen mit maximaler Empfindlichkeit bei 380nm und klarem Öltröpfchen
Zusätzlich existieren Doppelzapfen mit Empfindlichkeit des LWL-Zapfen.
Geckos
Der spezielle Aufbau der Netzhaut der Geckos spiegelt ihre evolutionäre Entwicklung wieder. Die reine Zapfennetzhaut mit Öltröpfchen der tagaktiven Echsen hat bei den nachtaktiven Geckos die Öltröpfchen verloren und die Zapfen haben sich stark vergrößert um die lichtempfindlichkeit zu erhöhen. Es sind drei Zapfen mit Empfindlicheit im uv, blau und grün erhalten geblieben. Die Taggeckos haben die Öltröpfchen nicht wieder entwickelt sondern nur die Größe der Zapfen reduziert und besitzen eine reine Zapfennetzhaut ohne Öltröpfchen.
Der Nachtaktive Tokeh (Gekko gekko) besitzt eine reine Stäbchenretina, jedoch mit unterschiedlichen Pigmenten mit maximaler Empfindlichkeit bei etwa 364nm, 450nm und 530nm [137Takenaka, N., & Yokoyama, S. (2007). Mechanisms of spectral tuning in the rh2 pigments of tokay gecko and american chameleon. Gene, 399(1), 26–32.].
Der Taggecko (Phelsuma madagascariensis longinsulae) besitzt eine Zapfenretina mit Rezeptoren im UVA, Blau und Grün [1290Taniguchi, Y., Hisatomi, O., Yoshida, M., & Tokunaga, F. (2001). Pinopsin expressed in the retinal photoreceptors of a diurnal gecko. FEBS Letters, 496(2), 69–74.; 271Taniguchi, Y., Hisatomi, O., Yoshida, M., & Tokunaga, F. (1999). Evolution of visual pigments in geckos. Federation of European Biochemical Societies Letters, 445(1), 36–40.]. Ein 1960 aufgenommenes Elektroretinogramm des Taggeckos (Phelsuma madagascariensis longinsulae) zeigt zwei Peaks bei 560 nm und 470 nm [1291Tansley, K. (1961). The retina of a diurnal gecko. Arch. Gen. Physiol. 272(3), 262–269.].
Der Tagaktive Blaue Rotkopfgecko (Gonatodes albogularis) besitzt ebenfalls drei Photorezeptoren mit maximaler Empfindlicheit bei 542 nm (grün), 475 nm (blau), and 362 nm (UVA) [443Ellingson, J. M., Fleishman, L. J., & Loew, E. R. (1995). Visual pigments and spectral sensitivity of the diurnal gecko gonatodes albogularis. Journal of Comparative Physiology A, 177(5), 559–567.]
Anolis
Anolis besitzen eine reine Zapfenretina, bei denen alle Einzelzapfen ein Öltröpfchen besitzen, die meisten Arten besitzen vier Farbpigmente mit maximaler Empfindlichkeit bei
- UVS-Zapfen mit maximaler Empfindlichkeit bei 365nm
- SWL-Zapfen mit maximaler Empfindlichkeit bei 455nm (Öltrtröpfchenfilter ab 378nm)
- MWL-Zapfen mit maximaler Empfindlichkeit bei 494nm (Öltrtröpfchenfilter ab 467nm)
- LWL-Zapfen mit maximaler Empfindlichkeit bei 564nm (Öltrtröpfchenfilter ab 502nm)
[54Loew, E. R., Fleishman, L. J., Foster, R. G., & Provencio, I. (2002). Visual pigments and oil droplets in diurnal lizards: a comparative study of caribbean anoles. Journal of Experimental Biology, 205, 927–938.] enthält eine Auflistung von Messwerten für 17 Anolis Arten, sowie Fotografien der Netzhaut.
Schlangen
Schlangen sind in ihrer Entwicklungsgeschichte besonders interessant, da Sie eng verwand mit den Echsen sind, ihr Auge sich jedoch durch eine sehr versteckte Lebensweise zurückgebildet hat, und später neu entwickelt werden musste. Ihre Netzhaut ist stark an die Lebensweise angepasst. Schlangen die in erster Linie nachtaktiv sind haben meist eine reine Stäbchen Netzhaut. Schlangen die hauptsächlich tagaktiv in einem ausreichend hellem Lebensraum sind haben eine reine Zapfenretina. Dazwischen gibt es auch Schlangen, die wie der Mensch, eine Retina haben, die sowohl aus Zapfen als auch aus Stäbchen aufgebaut ist. [139Sillman, A. J., Govardovskii, V. I., Röhlich, P., Southard, J. . A., & Loew, E. R. (1997). The photoreceptors and visual pigments of the garter snake (thamnophis sirtalis): A microspectrophotometric, scanning electron microscopic and immunocytochemical study. Journal of Comparative Physiology A, 181(2), 89–101.]
Bei der Strumpfbandnatter sind folgende Zapfentypen nachgewiesen [139Sillman, A. J., Govardovskii, V. I., Röhlich, P., Southard, J. . A., & Loew, E. R. (1997). The photoreceptors and visual pigments of the garter snake (thamnophis sirtalis): A microspectrophotometric, scanning electron microscopic and immunocytochemical study. Journal of Comparative Physiology A, 181(2), 89–101.]
- Einzelzapfen mit maximaler Empfindlichkeit bei 554nm
- Doppelzapfen bei denen beide Partner ihre maximale Empfindlichkeit bei 554nm haben
- Einzelzapfen mit maximaler Empfindlichkeit bei 481nm
- Einzelzapfen mit maximaler Empfindlichkeit bei 358nm
Königspythons hingegen haben ein Retina mit [867Sillman, A. J., Carver, J. K., & Loew, E. R. (1999). The photoreceptors and visual pigments in the retina of a boid snake, the ball python (python regius). Journal of Experimental Biology, 202(14), 1931–1938.]
- Stäbchen mit einer maximalen Empfindlichkeit bei 494 nm
- Zapfen mit einer maximalen Empfindlichkeit bei 551 nm
- Zapfen mit einer maximalen Empfindlichkeit bei 360 nm.
Anuren
Frösche der Gattung Rana und Kröten der Gattung Bufo besitzen ([1170GOVARDOVSKII, V. I., FYHRQUIST, N., REUTER, T., KUZMIN, D. G., & Donner, K. (2000). In search of the visual pigment template. Visual Neuroscience, 17(4), 509–528.; 1171REUTER, T., & Virtanen, K. (1976). color discrimination mechanisms in the retina of the toad (bufo bufo). Journal of comparative physiology, 109, 337–343.; 1172Liebman, P. A., & Entine, G. (1968). Visual pigments of frog and tadpole (rana pipiens). Vision Research, 8(7), 761–IN7.; 1173KOSKELAINEN, A., HEMILÄ, S., & DONNER, K. (1994). Spectral sensitivities of short- and long-wavelength sensitive cone mechanisms in the frog retina. Acta Physiologica Scandinavica, 152(1), 115–124.; 1174Hárosi, F. I. (1982). Recent results from single-cell microspectrophotometry: Cone pigments in frog, fish, and monkey. Color Research & Application, 7(2), 135–141.; 1175Hisatomi, O., Takahashi, Y., Taniguchi, Y., Tsukahara, Y., & Tokunaga, F. (1999). Primary structure of a visual pigment in bullfrog green rods. FEBS Letters, 447(1), 44–48.; 1176Bowmaker, J. K. (2008). Evolution of vertebrate visual pigments. Vision Research, 48(20), 2022–2041.; 1177Hisatomi, O., Kayada, S., Taniguchi, Y., Kobayashi, Y., Satoh, T., & Tokunaga, F. (1998). Primary structure and characterization of a bullfrog visual pigment contained in small single cones. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 119(3), 585–591.]):
- Blau-Sensitive Stäbchen mit ca. 430 nm Absorptionsmaximum
- Grün-Sensitive Stäbchen mit ca. 500 nm Absorptionsmaximum
- Blau-Sensitive Zapfen mit ca. 430 nm Absorptionsmaximum
- Grün-Sensitive Zapfen mit ca. 500nm Absorptionsmaximum
- Rot-Sensitive Zapfen mit ca. 565 nm Absorptionsmaximum
Außerdem befinden sich z.T. Öltropfen auf der Retina [1168Hailman, J. P. (1976). Oildroplets in the eyes of adult anuran amphibians: A comparative survey. Journal of Morphology, 148(4), 453–468.; 1169Korenyak, D., & Govardovskii, V. (2013). photoreceptors and visual pigments in three species of newts. Journal of Evolutionary Biochemistry and Physiology, 49, 399–407.]
Der Pfeilgiftfrosch Dendrobates pumilio besitzt ein ähnliches Farbsehen wie der Mensch [957Siddiqi, A., Cronin, T. W., Loew, E. R., Vorobyev, M., & Summers, K. (2004). Interspecific and intraspecific views of color signals in the strawberry poison frog dendrobates pumilio. Journal of Experimental Biology, 207(14), 2471–2485.]
- Grün-Sensitive Stäben mit ca 490 nm Absorptionsmaximum
- Blau-Sensitive Zapfen mit ca 465 nm Absorptionsmaximum
- Grün-Sensitive Zapfen mit ca 490 nm Absorptionsmaximum
- Rot-Sensitive Zapfen mit ca 560 nm Absorptionsmaximum
Verhaltensexperimente zur Untersuchung des Farbsehens
Verhaltensexperimente zur Untersuchung des Farbsehens beruhen darauf, dass man das Tier dazu bringt zu zeigen, ob es in der Lage ist zwei verschiedene Farben zu unterscheiden. Das kann entweder durch Dressur geschehen oder in dem man bestimmte Reflexe ausnutzt.
Eine Dressurmöglichkeit ist es, dem Tier zwei Farbfelder zur Auswahl zu geben, und es zu belohnen wenn es das langwelligere oder kurzwelligere Feld auswählt. Etwas flexibler ist das Training wenn drei Farbfelder zur Auswahl stehen, wovon zwei die selbe Farbe haben, und das Tier darauf trainiert wird, das Feld mit der unterschiedlichen Farbe zu wählen. Wenn man die Farben immer weiter annähert kann man den Punkt bestimmen, ab dem das Tier die Farben nicht mehr unterschieden kann, und nur noch in 50% der Fälle das richtige Farbfeld auswählt.
Historisch berühmt ist das Graukartenexperiment von Karl von Frisch 1914 für den Nachweis des Farbensehens der Bienen. Bienen wurden Zuckerwasser aus einer Schale die auf blauem Karton stand angeboten, wobei zusätzlich viele weitere Schalen mit reinem Wasser auf Kartons verschiedener Graustufen daneben standen. Die Bienen flogen, nachdem sie gelernt hatten, dass nur auf dem blauen Feld Zuckerwasser angeboten wird, immer zum blauen Feld auch wenn die Felder umgestellt wurden. Da sicherlich mindestens eine der Graukarten die selbe Helligkeit wie das blaue Feld hat, ist somit bewiesen dass die Tiere Blau als Farbe erkennen und von Grau unterschieden können.
Reflexe können ein Schnappreflex auf bewegte Beute sein. Die Beute hat dabei eine andere Farbe als der Hintergrund und die Farben werden immer weiter angenähert bis der Schnappreflex nachlässt, weil die Beute nicht mehr vom Hintergrund unterschieden werden kann. Ein optomotorisches Experiment besteht darin ein Tier in einen Streifenzylinder zu setzten, der sich gegenüber einem Hintergrund dreht. Bei langsamer Bewegung der Streifen folgen die Augen der Bewegung reflexartig. Farbe von Hintergrund und Streifen können dann ebenfalls immer weiter angenähert werden.
Wenn es gelingt nachzuweisen, dass ein Tier zwei Farben unabhängig von deren relativer Helligkeit unterschieden kann, ist der Nachweis des Farbsehens gegeben. Diese Versuche lassen sich auf quantitative Unterscheidungen der Wellenlängen und Farbmischexperimente ausdehnen.
Die Delta-Lambda-Funktion, oder auch Wellenlängenunterschiedungsvermögen genannt, gibt für jede Wellenlänge $\lambda$ an, wie weit eine zweite Wellenlänge entfernt sein muss ($\Delta\lambda$), damit die beiden von der Farbe her unterschieden werden können. Daraus entsteht die Delta-Lambda-Funktion: $\Delta\lambda(\lambda)$
Beim Menschen erhält man sehr unterschiedliche Kurven je nach genauer Versuchsanordnung. Ein Ergebnis ist:
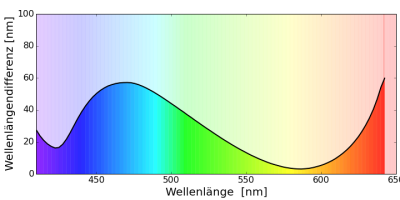
Salamander
Salamanderlarven waren in der Lage jeweils Gelb, Grün und Rot von verschiedenen Graustufen zu unterscheiden. Für Blau war das Training nicht erfolgreich, möglicherweise aber aufgrund zu geringer Intensität. [365Honjo, I. (1939). Farbensinn der feuersalamanderlarve. Memoirs of the College of Science, Kyoto Imperial University, 15(2).]
Da Amphibien schwer zu trainieren sind, wurde beim Salamander der Beutereflex ausgenutzt: Ein horizontaler Balken von der Größe eines Wurms der sich mit langsamer Geschwindigkeit bewegt genügt um vom Salamander als Beute wahrgenommen zu werden. Um die Farbunterscheidung zu testen wurde eine gefärbte Beuteattrappe vor einem gefärbten Hintergrund bewegt. Das Schnappverhalten verschwindet, wenn der Salamander die Beuteattrappe nicht mehr vom Hintergrund unterscheiden kann, weil die Farben zu ähnlich sind. Die Unterscheidung der Farben konnte sehr gut im Vergleich mit einem Trichromatischen Farbsehen mit drei Zapfen bei 440nm, 500nm und 570nm erklärt werden. [136Przyrembel, C., Keller, B., & Neumeyer, C. (1995). Trichromatic color vision in the salamander (salamandra salamandra). Journal of Comparative Physiology A, 176(4), 575–586.]
Gecko
Tarentola chazaliae konnte mit in einem Graukartenexperiment zwischen unbehandelten Heimchen von einer blauen Futterzange und stark salzigen (nicht schmeckenden) Heimchen von einer grauen Zange trotz schwankenden Intensität gut unterschieden. Besonders bemerkenswert ist diese Fähigkeit, da unter einer extrem dunklen Beleuchtung von nur 0.002cd/m² gearbeitet wurde. Beim Menschen erlischt das Farbsehen ab einer Helligkeit unter 0.02cd/m². Die verwendeten 0.002cd/m² entsprechen etwa der Helligkeit einer trüben Mondnacht. [208Roth, L. S. V., & Kelber, A. (2004). Nocturnal colour vision in geckos. Proceedings of the Royal Society of London - Biological Sciences, 271(Suppl 6), S485–S487.]
Schildkröten
Mit Rotwangenschmuckschildkröten (Peudemys scripta elegans) wurde das aufwändigste mir bekannte Experiment zum Farbsehen bei Tieren durchgeführt [3Arnold, K. E. (1986). Untersuchungen zur farbwahrnehmung der rotwangenschmuckschildkröte pseudemys scripta elegans. Unpublished Dissertation Dr. Johannes Gutenberg Universität, Mainz.][4Arnold, K. E., & Neumeyer, C. (1987). Wavelength discrimination in the turtle pseudemys scripta elegans. Vision Research, 27(9), 1501–1511.]. Zwei Tiere wurden in kleinen Aquarien gehalten und durch zwei Schläuche gefüttert, die direkt unter zwei Farbfeldern angebracht waren. Die Farbfelder konnten durch eine Glasfaser von hinten mit der gewünschten Farbe beleuchtet werden. Eines der Tiere wurde darauf trainiert zum Farbfeld mit der längeren Wellenlänge zu schwimmen, das andere auf das Farbfeld mit der kürzeren Wellenlänge. Die Tiere wurden durch den Futterschlauch mit Futter belohnt. Die beiden angebotenen Farben unterschieden sich am Anfang stark (100nm) und wurden dann immer stärker angenähert, bis keine Unterscheidung mehr möglich ist. Diesen Punkt erkennt man daran, dass das Tier nur noch in 50% der Fälle die richtige Farbtafel wählt (im Experiment wurde als Grenze 70% gewählt).
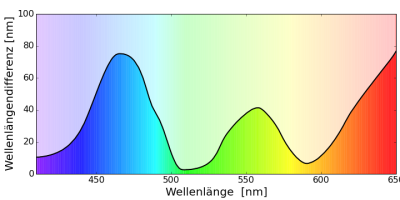
Die $\Delta\lambda$-Funktion hat drei Minima. Das ist ein sehr starker Hinweis darauf, dass das Farbsehen der Rotwangenschmuckschildkröte tetrachromatisch ist, die Rotwangenschmuckschildkröte also vier Zapfen in ihrem Auge hat. Besonders gut kann diese Schildkröte Farben im Bereich um 400nm, 510nm und 590nm unterschieden.
Zusätzlich wurden auch Farbmischexperimente durchgeführt. Wurden die Tiere auf 404nm (violett) trainiert so war es nicht - wie mein Menschen - möglich diesen Farbeindruck auch durch die Mischung von 450nm (blau) und 683nm (rot) zu erzeugen. Dagegen konnten 450nm (blau) und 367nm (UV) so gemischt werden, dass die Tiere das nicht von 404nm unterscheiden konnten.
Diese Experimente bestätigen sehr gut, dass das Farbsehen dieser Tiere sehr gut dem entspricht, was man auf Grund der Photorezeptoren (Farbraum) erwartet.
Auch für zwei Landschildkröten wurden Versuche zum Farbsehen durchgeführt.
Griechischen Landschildkröten (40 Stück) wurden jeweils zwei Blüten unterschiedlicher Farbe vor den Kopf gehalten und notiert, in welche Blüte die Schildkröte gebissen hat. Dieses Experiment wurde sowohl mit Papp-Blumen als auch mit echten Blumen durchgeführt. Die Tiere haben gelb/violett/(rot) Töne gegenüber blau/weiß bevorzugt. [599Pellitteri-Rosa, D., Sacchi, R., Galeotti, P., Marchesi, M., & Fasola, M. (2010). Do hermann's tortoises (testudo hermanni) discriminate colours? an experiment with natural and artificial stimuli. Italian Journal of Zoology, (early view),]
Ein ähnlicher Versuch, jedoch mit farbigen Tafeln, wurde mit Pantherschildkröten durchgeführt. Auch hier unterschieden die Tiere unterschiedliche Farben und zeigten eine Präferenz für rot und hellgrün [630Simang, A., Cunningham, P. L., & Henen, B. T. (2010). Color selection by juvenile leopard tortoises (stigmochelys pardalis) in namibia. Journal of Herpetology, 44(2), 327–331.].
Anuren
Frösche (Rana) und Kröten (Bufo) zeigten bei extremer Dunkelheit noch ein hervorragendes Farbsehen im Verhaltensexperiment [1167Yovanovich, C. A. M., Koskela, S. M., Nevala, N., Kondrashev, S. L., Kelber, A., & Donner, K. (2017). The dual rod system of amphibians supports colour discrimination at the absolute visual threshold. Philosophical Transactions of the Royal Society B: Biological Sciences, 372(1717), 20160066.]
Beispiele der Färbung von Reptilien im UV-Bereich
Es ist also gut belegt, dass Reptilien UV als eigene Grundfarbe sehen können. Farbe spielt in der innerartlichen Kommunikation von Reptilien eine wichtige Rolle [1184Olsson, M., Stuart-Fox, D., & Ballen, C. (2013). Genetics and evolution of colour patterns in reptiles. Seminars in Cell & Developmental Biology, 24(6), 529–541.]. Viele Echsen zeigen ein ausgeprägtes Muster im UV, eine Übersicht enthält [332Font, E., & Molina-Borja, M. (2004). Ultraviolet reflectance of color patches in gallotia galloti lizards from tenerife, canary islands. In V. Pérez-Mellado, N. Riera & A. Perera (Eds), The Biology of Lacertid lizards. Evolutionary and Ecological Perspectives (pp. 201–221). Recerca: Institut Menorquí d’Estudis.].
Westkanareneidechse: Bläuliches UV und UV+Gelb
Die Färbung der Westkanareneidechsen (Gallotia galloti) erscheint dem menschlichen Auge als grau-braune Grundfärbung mit gelblichen und blauen Flecken. Die Färbung dieser Tiere wurde im sichtbaren Bereich mit einer normalen Kamera, einer schwarz-weiß-Kamera mit Empfindlichkeit im VIS-Bereich und im UVA-Bereich aufgenommen [332Font, E., & Molina-Borja, M. (2004). Ultraviolet reflectance of color patches in gallotia galloti lizards from tenerife, canary islands. In V. Pérez-Mellado, N. Riera & A. Perera (Eds), The Biology of Lacertid lizards. Evolutionary and Ecological Perspectives (pp. 201–221). Recerca: Institut Menorquí d’Estudis.] (Der Artikel ist aufgrund seiner Bilder sehr empfehlenswert!). Die blauen Flecken haben eigentlich eine Mischfarbe aus blau und UV, wobei UV dominiert. Sind diese Flecken schon für das menschliche Auge sehr intensiv steigert sich die Intensität für Tetrachromaten noch zusätzlich. Die genaue UV-Färbung war bei den untersuchten Tieren zusätzlich geschlechtsabhängig [369Molina-Borja, M., Font, E., & Mesa Avila, G. (2006). Sex and population variation in ultraviolet reflectance of colour patches in gallotia galloti (fam. lacertidae) from tenerife (canary islands). Journal of Zoology, 268(2), 193–206.].
Interessant ist auch, dass einige – aber nicht alle! – der gelben Flecken zusätzlich im UV reflektieren. Sie sind also nicht gelb sondern haben eine Mischfarbe aus gelb und UV, eine Farbe die auch bei Blüten sehr häufig auftritt.
Perleidechse: Bläuliches UV

Foto: Lanzi via Wikimedia
Die Perleidechse (Timon lepidus) zeigt ebenfalls eine sehr starke UV-Färbung. Die Tiere haben auf den Seiten blauschwarze Flecken die eine starke UV-Färbung besitzen, also wieder eine Mischfarbe aus blau und UV mit hohem UV-Anteil sind, quasi ein “bläuliches UV”, von dem wir nur einen schwachen blauen Ausläufer erkennen.


Tyrrhenische Mauereidechse (Podarcis tiliguerta): Blau + UVA
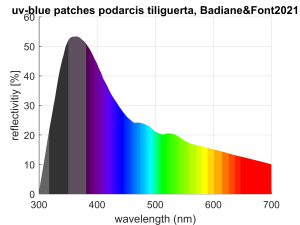 Bei der Tyrrhenischen Mauereidechse (Podarcis tiliguerta) wurde das Reflexionsspektrum der blauen Punkte gemessen. [1385Badiane, A., & Font, E. (2021). Information content of ultraviolet-reflecting colour patches and visual perception of body coloration in the tyrrhenian wall lizard podarcis tiliguerta. Behavioral Ecology and Sociobiology, 75,]
Bei der Tyrrhenischen Mauereidechse (Podarcis tiliguerta) wurde das Reflexionsspektrum der blauen Punkte gemessen. [1385Badiane, A., & Font, E. (2021). Information content of ultraviolet-reflecting colour patches and visual perception of body coloration in the tyrrhenian wall lizard podarcis tiliguerta. Behavioral Ecology and Sociobiology, 75,]
Zaunleguan: Reines Blau
Der Zaunleguan (Sceloporus undulatus) hat eine grau-braune Grundfärbung mit leichte blaue Färbung an Bauch und Hals, bei Männchen ist diese Färbung sehr viel ausgeprägter und erscheint zur Balz in einem leuchtenden Blau. Im Gegensatz zu den anderen Beispielen ist dieses Blau tatsächlich ein leuchtendes Blau und enthält so gut wie keinen UV-Anteil! [245Stoehr, A. M., & McGraw, K. J. (2001). Ultraviolet reflectance of color patches in male sceloporus undulatus and anolis carolinensis. Journal of Herpetology, 35, 168–171.]
Anolis
Anolis setzen bei der innerartlichen Kommunikation ihre Kehlfahne sehr effektvoll ein. Bereits für das menschliche Auge ist sie stark kontrastierend zur Färbung der Tiere und zum Hintergrund gefärbt. Bei Arten die in ihrem Habitat einem hohen Anteil an UV-Strahlung ausgesetzt sind (Anolis krugi, A. cristatellus), hat die Kehlfahne einen höheren UV-Farbanteil als bei Arten mit wenig UV-Licht im Habitat (A. evermanni). [241Fleishman, L. J., Loew, E. R., & Leal, M. (1993). Ultraviolet vision in lizards. Nature, 365, 397.]
Das selbe ist für die beiden sympatrischen Anolisarten Anolis cooki und Anolis cristatellus bekannt. Nur das Umgebungslicht im einen Mikrohabitat von Anolis cooki ist reich an UVA-Strahlung. Entsprechend angepasst reflektiert die Kehlfahne von Anolis cooki schwach im UVA-Bereich während die Kehlfahne von Anolis cristatellus stark UVA gefärbt ist. Die Farbe der Kehlfahnen kontrastiert also bei beiden Arten sehr stark zur Hintergrundfärbung. [49Leal, M., & Fleishman, L. J. (2002). Evidence for habitat partitioning based on adaptation to environmental light in a pair of sympatric lizard species. Proceedings of the Royal Society of London - Biological Sciences, 269(1489), 351–359.]
Wüstenleguan
Der Wüstenleguan (Dipsosaurus dorsalis) setzt zur Markierung seines Reviers über die Femoralporen Duftstoffe ab. Die verwendete Substanz absorbiert sehr stark im UV ist im sichtbaren Bereich aber nahezu unsichtbar. Im Verhaltensexperiment wurde nachgewiesen, dass der Wüstenleguan Sekretspuren über eine große Distanz optisch anhand der UV-Absorption wahrnimmt. Er hat bei UV absorbierender Tinte, die keine Duftstoffe enthielt, mit dem gleichen Verhalten wie auf Sekret reagiert, und das Sekret bei Beleuchtung ohne UVA nicht erkennen können. [213Alberts, A. C. (1989). Ultraviolet visual sensitivity in desert iguanas: implications for pheromone detection. Animal Behaviour, 38(1), 129–137.]
Ctenophorus ornatus
Bei der Agame Ctenophorus ornatus wählen Männchen diejenigen Weibchen mit starker UVA-Färbung an Hals und Brust. Die Brust ist durch ihre UVA-Färbung vom Bauch abgegrenzt, was für das menschliche Auge nicht erkennbar ist. [268LeBas, N. R., & Marshall, N. J. (2000). The role of colour in signalling and male choice in the agamid lizard ctenophorus ornatus. Proceedings of the Royal Society of London - Biological Sciences, 267(1442), 445–452.]
Östliche Smaragdeidechse (//Lacerta viridis//)
Auch bei der östlichen Smaragdeidechse ist nachgewiesen, dass Männchen mit einer hohen UVA-Färbung am Hals bei der Paarung bevorzugt werden [1185Bajer, K., Molnár, O., Török, J., & Herczeg, G. (2011). Ultraviolet nuptial colour determines fight success in male european green lizards (lacerta viridis). Biol Lett, 7(6), 866–868.]
Augrabies-Plattgürtelechse (Platysaurus broadleyi)
Bei den Augrabies-Plattgürtelechse können sich die Männchen mit intensiver UV-Färbung gegenüber ihren Kontrahenten besser durchsetzen [260Whiting, M. J., Stuart-Fox, D. M., O'Connor, D., Firth, D., Bennett, N. C., & Blomberg, S. P. (2006). Ultraviolet signals ultra-aggression in a lizard. Animal Behaviour, 72(2), 353–363.]
Leopardgeckos (Eublepharis macularius)
Die Färbung von Leopardgeckos beinhaltet UVA [1183Abramjan, A., Baranová, V., Frýdlová, P., Landová, E., & Frynta, D. (2020). Ultraviolet reflectance and pattern properties in leopard geckos (eublepharis macularius). Behavioural Processes, 173, 104060.]. Die Lichtfarbe in der Dämmerung ändert sich zu hohen Farbtemperaturen, was auch einen hohen relativen Anteil an UVA beinhaltet. Somit sehen Leopardgeckos unter natürlichem Licht die UVA-Färbung ihrer Artgenossen deutlich.
Blütenfarben mit und ohne UV
Eine sehr umfassende Arbeit über die Farben von Blüten stellt [376Chittka, L., Shmida, A., Troje, N., & Menzel, R. (1994). Ultraviolet as a component of flower reflections, and the colour perception of hymenoptera. Vision Research, 34(11), 1489–1508.] dar. Das Spektrum von über Tausend Blüten und Blätter wurde im Bereich von 300nm bis 700nm (ausreichend für trichromatische Tiere mit UV, Blau und Grün-Zapfen, wie z.B. Insekten der Gruppe Hymenoptera). Die Autoren stellen fest, dass sich 94% aller Blüten 10 verschiedenen Farben zuordnen lassen.
Das klassische und auch sehr eindrucksvolle Beispiel für UV-Färbung stellt das Farbmuster von Blüten dar, das beispielsweise von Bienen sehr gut erkannt wird. Sehr schöne Bilder dazu finden sich auf der Homepage von Bjørn Rørslett.
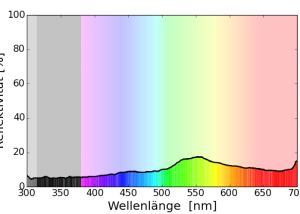
Ich zeige hier ein eigenes Foto von der Topinambur-Blüte, das zeigt, dass die Blüte nur für den Menschen “langweilig” einfarbig aussieht:
Weitere eindrucksvolle Blütenmuster haben:
- Gänsefingerkraut (Potentilla anserina)
- Nachtkerze (Oenothera biennis)
- kriechendes Fingerkraut (Potentilla reptans)
Eine Übersicht über die verschiedenen Blütenfarben
- Gelb ohne UVA (17 % der Blüten)
Beispiel: Gewöhnliche Hornklee (Lotus corniculatus) - Gelb mit UVA (13 % der Blüten)
Beispiel: Frühlings-Greiskraut (Senecio vernalis) - “Weiß” ohne UVA (20 % der Blüten)
Beispiel: Graukresse (Bertorea incarna) - “echtes” Weiß mit UVA (1 % der Blüten)
Beispiel: Sommerlicher Affodill (Asphodelus aestivus) - Creme (4 % der Blüten)
- Blau-Purpur-Rosa (25 % der Blüten)
Beispiel: Blaue Himmelsleiter (Polemonium coerulum) - Blau-Lila-Purpur (10 % der Blüten)
Beispiel: Dunkles Lungenkraut (Pulmonaria obscura) - Rot ohne UVA (2 % der Blüten)
Beispiel: Klatschmohn (Papaver rhoeas) - Rot mit UVA (3 % der Blüten)
Beispiel: Jacobine (Justicia rizzinii, Jacobinia pauciflora) - Grün (1%, Blätter)
Bild Graukresse auf Wikimedia, Bild Sommerlicher Affodill auf Wikimedia }}]
Bild auf Wikipedia Commons und Acker-Witwenblume (Knautia arvensis) Bild auf Wikipedia Commons Bild auf Wikipedia Commons
Versuch einer Analogie: Was bedeutet es, UV nicht sehen zu können?
Wenn Reptilien, die UVA sehen können, unter einer Beleuchtung leben müssen, die kein UVA enthält, macht man diese Tiere effektiv “UVA-blind”. Diese Tiere sehen dann die oben als Beispiel gezeigt Alpenarnika nicht mehr zweifarbig mit einfarbig gelben und gelb-UVA-gemischten Blütenblättern sondern wie der Mensch nur einfarbig gelbe Blüten. Ohne UVA-Beleuchtung sehen sie die UVA-Färbung des Futters und ihrer Artgenossen nicht. Das ist ein harter Fakt. Die Farbe von Objekten unter einer Lampe kann man einfach ausrechnen. Das geht sowohl für den Menschen als auch für Reptilien (siehe auch Abschnitt Farbsehen).
Vielleicht wird dieser Farbverlust anschaulich, wenn wir uns vorstellen, was es für den Menschen bedeutet, eine Farbe nicht sehen zu können. Etwa 9% der Männer und knapp unter 1% der Frauen haben eine Rot-Grün-Sehschwäche (Deuteranomalie, Deuteranopie, Protanomalie oder Protanopie). Während einem Normalsichtigen rotes Obst im grünen Laub förmlich “ins Auge springt”, tarnt es sich für Menschen mit einer Grün-Schwäche, für Menschen mit einer Grün-Blindheit wird es völlig unsichtbar. Auch die Unterscheidung zwischen reifem und unreifem Obst fällt diesen Menschen schwer.

\\Foto: Viola sonans CCBYSA, Wikimedia
Was hingegen wissenschaftlich nicht untersucht ist, ist die Frage ob es Reptilien “stört”, wenn eine Farbe in ihrer Wahrnehmung fehlt. Es gibt zwar Studien, die zeigen, dass die UVA-Färbung bei der Balz eine Rolle spielen und auch die Futterpflanzen reflektieren im UVA, aber in der geschützten Umgebung des Terrariums und wenn keine Nachzucht erwünscht ist, überleben die Tiere sicher auch ohne UVA sehen zu können. Ob es sich in irgendeiner Form auf das Wohlbefinden auswirkt, ober ob Tiere zwischen zwei absolut identisch eingerichteten Terrarien (ohne Streulicht vom einen zum anderen Terrarium) wählen würden, wen eines davon mit, das andere ohne UVA beleuchtet ist, wurde meines Wissens bisher nicht untersucht.
Häufiger taucht die Frage auf, ob man das fehlende UV einer Lampe (z.B. einer LED) durch eine Lampe mit viel UVA (z.B. Bright Sun UV Desert) ausgleichen kann. Ich halte das für schwierig. Man kann Lampen sehr gut kombinieren, wenn es um unterschiedliche Aufgaben geht: Grundbeleuchtung mit Leuchtstoffröhren und Sonnenplatzbeleuchtung mit Metallhalogeniddampflampen. Oder Grundbeleuchtung ohne UVB und UVB-Strahlung am Sonnenplatz. Oder UVB-Bestrahlung ohne Wärme durch Leuchtstofflampen zusammen mit Wärmestrahlung durch Glühbirnen, die hauptsächlich Infrarotstrahlung abstrahlen. Hier wird sichtbare und unsichtbare Strahlung kombiniert oder sichtbare Strahlung mit ähnlicher Farbe. Der Mensch reagiert beim Farbsehen aber sehr empfindlich darauf, wenn verschieden farbiges Licht kombiniert wird, und die Lichtquellen nicht sehr nahe bei einander sind. Solange nichts gegenteiliges bekannt ist, gehe ich davon aus, dass Reptilien ähnlich reagieren. Die Kombination einer UV-Leuchtstofflampe (für den Menschen weiß, für ein Reptil mit Türkisen Farbstich) mit einer Halogenidmetalldampflampe am Sonnenplatz kombiniert für den Menschen weißes mit weißem Licht, für ein Reptil jedoch farbiges mit weißem Licht.
Literatur
[45] Kelber, A., Vorobyev, M., & Osorio, D. (2003). Animal colour vision - behavioural tests and physiological concepts. Biological Reviews, 78, 81–118.
[12] Bowmaker, J. K., & Loew, E. R. (2005). The cone photoreceptors and visual pigments of chameleons. Journal of Comparative Physiology A, 191(10), 925–932.
[443] Ellingson, J. M., Fleishman, L. J., & Loew, E. R. (1995). Visual pigments and spectral sensitivity of the diurnal gecko gonatodes albogularis. Journal of Comparative Physiology A, 177(5), 559–567.
[601] Röll, B. (2000). Carotenoid and retinoid -- two pigments in a gecko eye lens. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology, 125(1), 105–112.
[2] Ammermüller, J., & Kolb, H. (1996). Functional architecture of the turtle retina. Progress in Retinal and Eye Research, 15(2), 393–433.
[53] Loew, E. R., & Govardovskii, V. I. (2001). Photoreceptors and visual pigments in the red-eared turtle, trachemys scripta elegans. Visual Neuroscience, 18(5), 753–757.
[137] Takenaka, N., & Yokoyama, S. (2007). Mechanisms of spectral tuning in the rh2 pigments of tokay gecko and american chameleon. Gene, 399(1), 26–32.
[1290] Taniguchi, Y., Hisatomi, O., Yoshida, M., & Tokunaga, F. (2001). Pinopsin expressed in the retinal photoreceptors of a diurnal gecko. FEBS Letters, 496(2), 69–74.
[271] Taniguchi, Y., Hisatomi, O., Yoshida, M., & Tokunaga, F. (1999). Evolution of visual pigments in geckos. Federation of European Biochemical Societies Letters, 445(1), 36–40.
[1291] Tansley, K. (1961). The retina of a diurnal gecko. Arch. Gen. Physiol. 272(3), 262–269.
[54] Loew, E. R., Fleishman, L. J., Foster, R. G., & Provencio, I. (2002). Visual pigments and oil droplets in diurnal lizards: a comparative study of caribbean anoles. Journal of Experimental Biology, 205, 927–938.
[139] Sillman, A. J., Govardovskii, V. I., Röhlich, P., Southard, J. . A., & Loew, E. R. (1997). The photoreceptors and visual pigments of the garter snake (thamnophis sirtalis): A microspectrophotometric, scanning electron microscopic and immunocytochemical study. Journal of Comparative Physiology A, 181(2), 89–101.
[867] Sillman, A. J., Carver, J. K., & Loew, E. R. (1999). The photoreceptors and visual pigments in the retina of a boid snake, the ball python (python regius). Journal of Experimental Biology, 202(14), 1931–1938.
[1170] GOVARDOVSKII, V. I., FYHRQUIST, N., REUTER, T., KUZMIN, D. G., & Donner, K. (2000). In search of the visual pigment template. Visual Neuroscience, 17(4), 509–528.
[1171] REUTER, T., & Virtanen, K. (1976). color discrimination mechanisms in the retina of the toad (bufo bufo). Journal of comparative physiology, 109, 337–343.
[1172] Liebman, P. A., & Entine, G. (1968). Visual pigments of frog and tadpole (rana pipiens). Vision Research, 8(7), 761–IN7.
[1173] KOSKELAINEN, A., HEMILÄ, S., & DONNER, K. (1994). Spectral sensitivities of short- and long-wavelength sensitive cone mechanisms in the frog retina. Acta Physiologica Scandinavica, 152(1), 115–124.
[1174] Hárosi, F. I. (1982). Recent results from single-cell microspectrophotometry: Cone pigments in frog, fish, and monkey. Color Research & Application, 7(2), 135–141.
[1175] Hisatomi, O., Takahashi, Y., Taniguchi, Y., Tsukahara, Y., & Tokunaga, F. (1999). Primary structure of a visual pigment in bullfrog green rods. FEBS Letters, 447(1), 44–48.
[1176] Bowmaker, J. K. (2008). Evolution of vertebrate visual pigments. Vision Research, 48(20), 2022–2041.
[1177] Hisatomi, O., Kayada, S., Taniguchi, Y., Kobayashi, Y., Satoh, T., & Tokunaga, F. (1998). Primary structure and characterization of a bullfrog visual pigment contained in small single cones. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 119(3), 585–591.
[1168] Hailman, J. P. (1976). Oildroplets in the eyes of adult anuran amphibians: A comparative survey. Journal of Morphology, 148(4), 453–468.
[1169] Korenyak, D., & Govardovskii, V. (2013). photoreceptors and visual pigments in three species of newts. Journal of Evolutionary Biochemistry and Physiology, 49, 399–407.
[957] Siddiqi, A., Cronin, T. W., Loew, E. R., Vorobyev, M., & Summers, K. (2004). Interspecific and intraspecific views of color signals in the strawberry poison frog dendrobates pumilio. Journal of Experimental Biology, 207(14), 2471–2485.
[365] Honjo, I. (1939). Farbensinn der feuersalamanderlarve. Memoirs of the College of Science, Kyoto Imperial University, 15(2).
[136] Przyrembel, C., Keller, B., & Neumeyer, C. (1995). Trichromatic color vision in the salamander (salamandra salamandra). Journal of Comparative Physiology A, 176(4), 575–586.
[208] Roth, L. S. V., & Kelber, A. (2004). Nocturnal colour vision in geckos. Proceedings of the Royal Society of London - Biological Sciences, 271(Suppl 6), S485–S487.
[3] Arnold, K. E. (1986). Untersuchungen zur farbwahrnehmung der rotwangenschmuckschildkröte pseudemys scripta elegans. Unpublished Dissertation Dr. Johannes Gutenberg Universität, Mainz.
[4] Arnold, K. E., & Neumeyer, C. (1987). Wavelength discrimination in the turtle pseudemys scripta elegans. Vision Research, 27(9), 1501–1511.
[599] Pellitteri-Rosa, D., Sacchi, R., Galeotti, P., Marchesi, M., & Fasola, M. (2010). Do hermann's tortoises (testudo hermanni) discriminate colours? an experiment with natural and artificial stimuli. Italian Journal of Zoology, (early view),
[630] Simang, A., Cunningham, P. L., & Henen, B. T. (2010). Color selection by juvenile leopard tortoises (stigmochelys pardalis) in namibia. Journal of Herpetology, 44(2), 327–331.
[1167] Yovanovich, C. A. M., Koskela, S. M., Nevala, N., Kondrashev, S. L., Kelber, A., & Donner, K. (2017). The dual rod system of amphibians supports colour discrimination at the absolute visual threshold. Philosophical Transactions of the Royal Society B: Biological Sciences, 372(1717), 20160066.
[1184] Olsson, M., Stuart-Fox, D., & Ballen, C. (2013). Genetics and evolution of colour patterns in reptiles. Seminars in Cell & Developmental Biology, 24(6), 529–541.
[332] Font, E., & Molina-Borja, M. (2004). Ultraviolet reflectance of color patches in gallotia galloti lizards from tenerife, canary islands. In V. Pérez-Mellado, N. Riera & A. Perera (Eds), The Biology of Lacertid lizards. Evolutionary and Ecological Perspectives (pp. 201–221). Recerca: Institut Menorquí d’Estudis.
[369] Molina-Borja, M., Font, E., & Mesa Avila, G. (2006). Sex and population variation in ultraviolet reflectance of colour patches in gallotia galloti (fam. lacertidae) from tenerife (canary islands). Journal of Zoology, 268(2), 193–206.
[1385] Badiane, A., & Font, E. (2021). Information content of ultraviolet-reflecting colour patches and visual perception of body coloration in the tyrrhenian wall lizard podarcis tiliguerta. Behavioral Ecology and Sociobiology, 75,
[245] Stoehr, A. M., & McGraw, K. J. (2001). Ultraviolet reflectance of color patches in male sceloporus undulatus and anolis carolinensis. Journal of Herpetology, 35, 168–171.
[241] Fleishman, L. J., Loew, E. R., & Leal, M. (1993). Ultraviolet vision in lizards. Nature, 365, 397.
[49] Leal, M., & Fleishman, L. J. (2002). Evidence for habitat partitioning based on adaptation to environmental light in a pair of sympatric lizard species. Proceedings of the Royal Society of London - Biological Sciences, 269(1489), 351–359.
[213] Alberts, A. C. (1989). Ultraviolet visual sensitivity in desert iguanas: implications for pheromone detection. Animal Behaviour, 38(1), 129–137.
[268] LeBas, N. R., & Marshall, N. J. (2000). The role of colour in signalling and male choice in the agamid lizard ctenophorus ornatus. Proceedings of the Royal Society of London - Biological Sciences, 267(1442), 445–452.
[1185] Bajer, K., Molnár, O., Török, J., & Herczeg, G. (2011). Ultraviolet nuptial colour determines fight success in male european green lizards (lacerta viridis). Biol Lett, 7(6), 866–868.
[260] Whiting, M. J., Stuart-Fox, D. M., O'Connor, D., Firth, D., Bennett, N. C., & Blomberg, S. P. (2006). Ultraviolet signals ultra-aggression in a lizard. Animal Behaviour, 72(2), 353–363.
[1183] Abramjan, A., Baranová, V., Frýdlová, P., Landová, E., & Frynta, D. (2020). Ultraviolet reflectance and pattern properties in leopard geckos (eublepharis macularius). Behavioural Processes, 173, 104060.
[376] Chittka, L., Shmida, A., Troje, N., & Menzel, R. (1994). Ultraviolet as a component of flower reflections, and the colour perception of hymenoptera. Vision Research, 34(11), 1489–1508.
[362] Wyszecki, G., & Stiles, W. S. (2000). Color science: Concepts and methods, quantitative data and formulae 2nd ed. John Wiley and Sons.
[1200] Toomey, M. B., & Corbo, J. C. (2017). evolution, development and function of vertebrate cone oil droplets. Frontiers in neural circuits, 11(97).







Discussion